1月24日,两篇来自中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)的论文同时在国际顶级学术期刊《细胞》在线发表。
中国科学院脑智卓越中心竺淑佳研究组和上海药物研究所李扬研究组合作完成。研究团队通过提取大鼠大脑皮层和海马中的内源nmda受体并解析出3种主要亚型及比例,揭示内源ndma受体的原子分辨率三维结构,突破了nmda受体的分子结构与功能研究局限于异源重组表达系统的瓶颈。该成果为开发靶向nmda受体治疗神经或精神类疾病的新型药物提供了重要的理论基础。
中国科学院脑智卓越中心/上海脑科学与类脑研究中心刘真、孙怡迪、朱文成,复旦大学附属中山医院生殖医学中心木良善,以及上海交通大学医学院李辰合作完成,从蛋白质动态层面解读人类早期胚胎发育的成功与失败。该研究为理解哺乳动物着床前胚胎发育提供了跨物种的新资源,为通过多组学解析早期胚胎发育机制提供了新思路,也为研究人类着床前胚胎发育失败建立了新范式。
下面请看具体报道
成年哺乳动物大脑皮层和海马内源nmda受体的组装和结构
近年来的临床医学研究揭示nmda受体功能障碍直接与一系列神经及精神疾病密切相关,包括nmda受体突变相关的罕见病、癫痫、精神分裂症和自身免疫性脑炎等。因此,nmda受体一直是脑疾病领域药物设计最热门的靶点,已有靶向nmda受体的分子(如氯胺酮、美金刚、右美沙芬)用于临床治疗抑郁症和阿尔茨海默症。
在哺乳动物中,nmda受体由7个不同基因编码形成7个不同亚基。有功能的nmda受体通常由两个必需的glun1亚基和两个可变的glun2/3(n2a-n2d,n3a-n3b)亚基组装形成二异或三异四聚体(图1)。
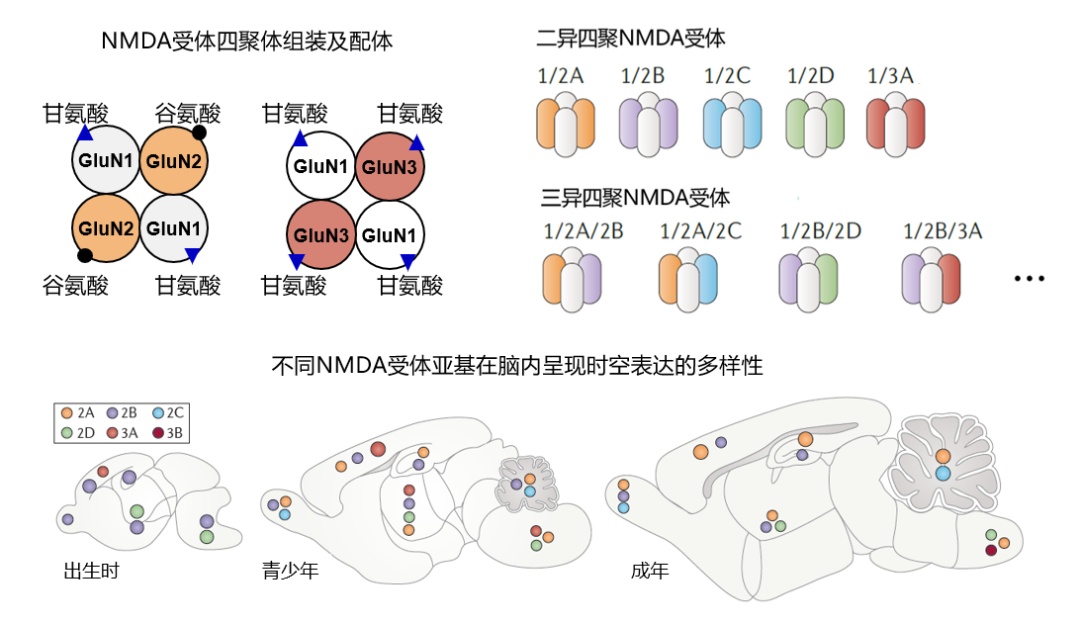
图1. nmda受体亚基时空表达和四聚体组装的多样性。功能性nmda受体由两个必需的glun1亚基和两个可变的glun2或glun3亚基组装形成四聚体。在不同的发育阶段,脑内关键nmda受体不同亚型的分布及功能存在多样性。
为了从脑组织中分离出内源nmda受体,竺淑佳团队通过多年的技术积累,定制了靶向各个nmda受体亚基的构象特异性单克隆抗体。团队通过异源重组表达的不同nmda亚型蛋白逐一免疫小鼠,通过杂交瘤技术及活细胞染色筛选出了靶向nmda受体各亚基的选择性单抗(图2)。
借助这些实验室自制的超高亲和力抗体工具(亲和力在纳摩尔数量级),研究团队成功从成年大鼠的大脑皮层和海马中富集和分离出了丰度极低的内源nmda受体。
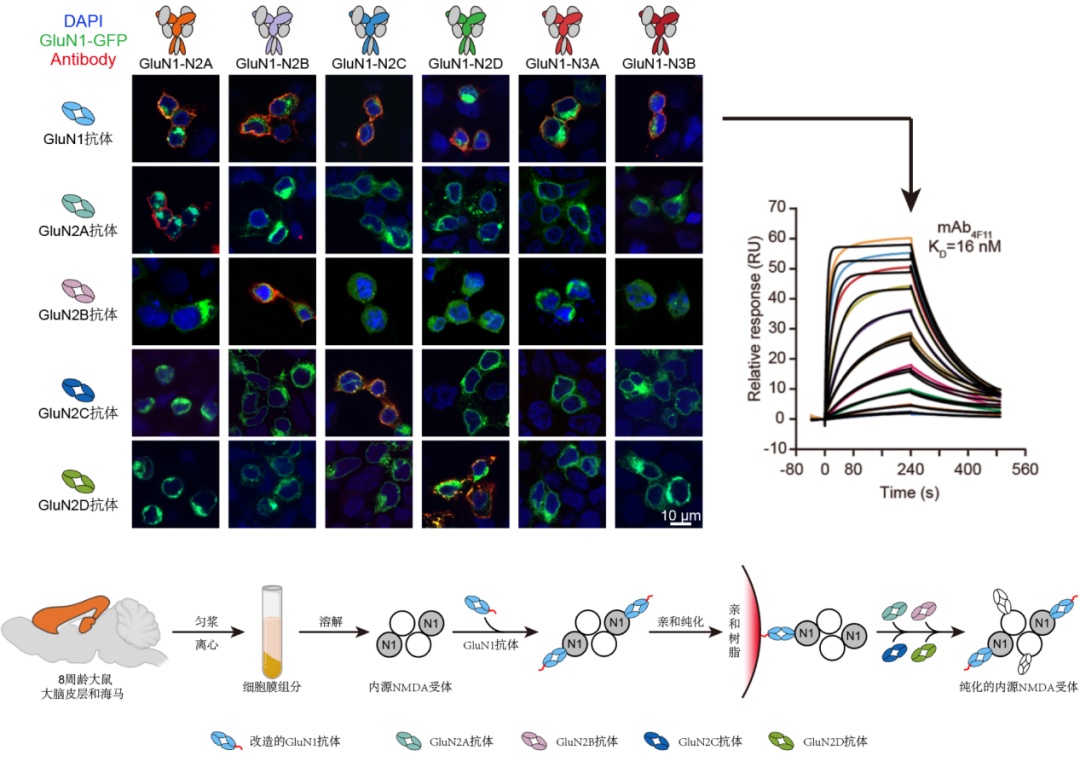
图2. 靶向nmda受体亚基的高亲和力单抗的开发和内源nmda受体的富集纯化策略。杂交瘤技术及活细胞荧光成像方法制备及鉴定结合不同nmda受体亚型的单克隆抗体。利用纳摩尔级别的glun1单抗纯化出皮层海马中内源nmda受体,并加入构象特异性和亚基选择性的glun2抗体进行标记及分析。
通过冷冻电镜(cryo-em)技术,团队从皮层和海马中的内源nmda受体解析出了3种主要的受体亚型:glun1-n2a-n2b三异四聚体,glun1-n2b和glun1-n2a二异四聚体,分别占据45%,35%和20%的比例(图3)。
该研究表明glun1-n2a-n2b三异四聚体是内源丰度最高的亚型,强调了glun2a和glun2b亚基在生理状态同一受体中的功能整合。更新了领域内三十年来认为发育关键期(developmental switch)是从glun1-2b转变为glun1-2a的观点,应修正为从出生时glun1-2b转变为成年的glun1-2a-2b, glun1-2b和glun1-2a三种亚型共存的结论。
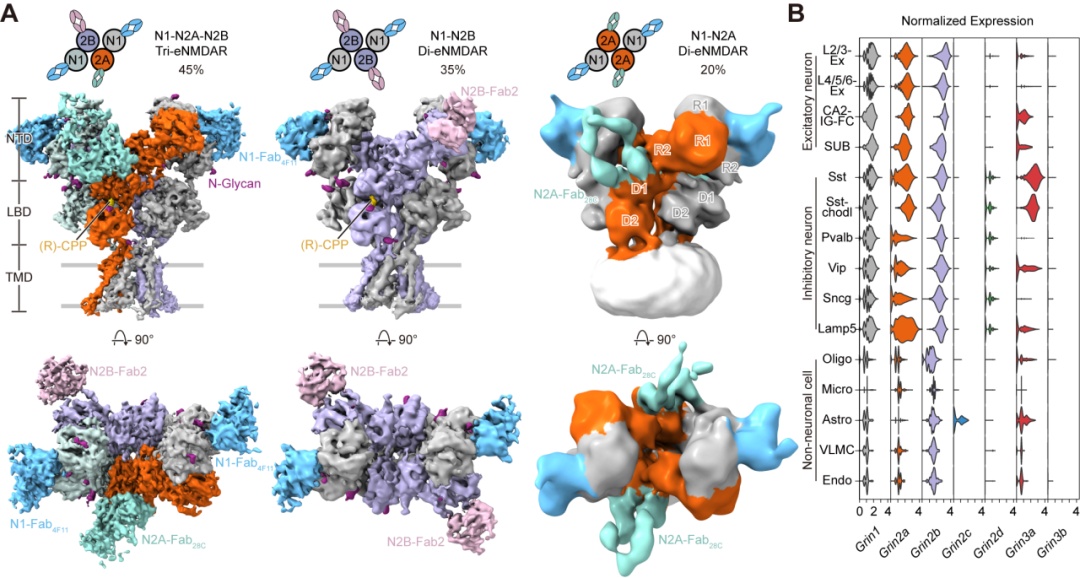
图3. 皮层和海马内源nmda受体的主要亚型和不同亚基在单细胞转录组水平上的分布。
研究团队进一步通过结构对比发现了glun2b亚基在glun1-n2a-n2b三异四聚体和glun1-n2b二异四聚体中的构象区别,揭示了同一亚基在不同受体中存在构象差异,将决定不同亚型的生物物理学、药理学和通道开放属性(图4)。
不同内源nmda受体间的构象差异,为理解内源nmda受体的功能多样性,以及不同受体的药理差异提供了分子基础。该发现为设计具有亚基特异性且具有亚型偏好性的化合物提供了可能,有助于提高nmda受体药物的靶向性。
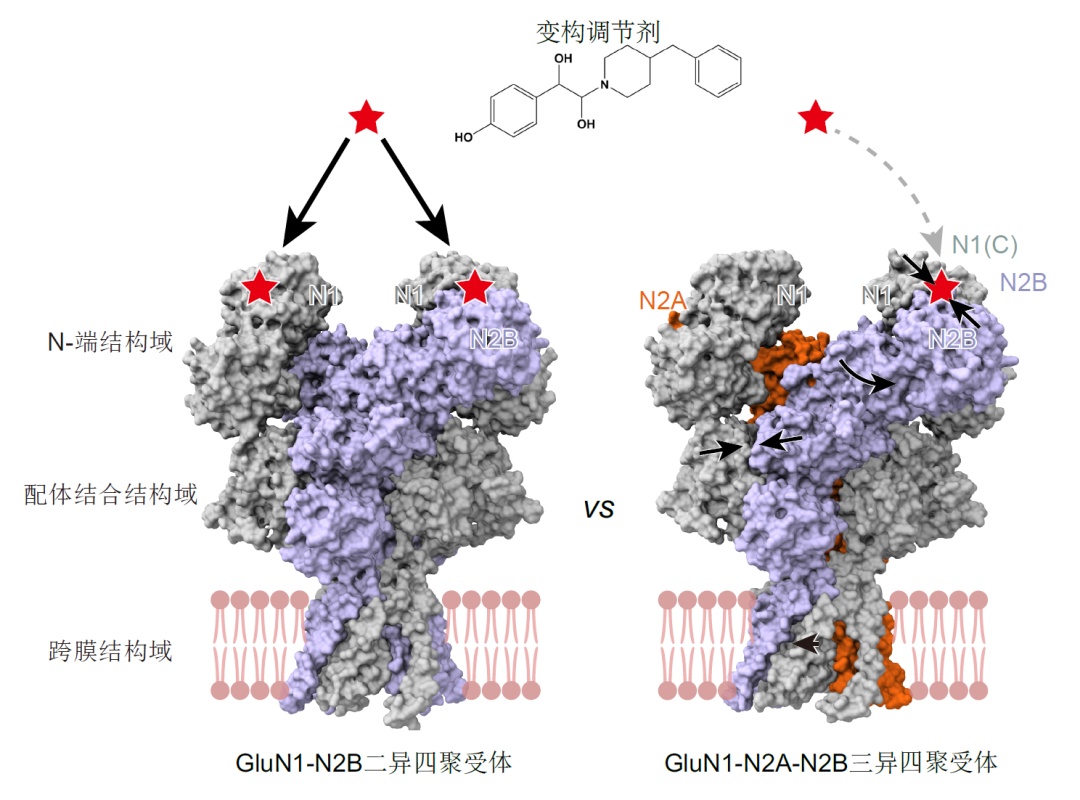
图4. 内源nmda受体亚型间的构象及药理学特性差异。
该研究范式突破了几十年来nmda受体的分子结构局限于体外异源重组表达系统的瓶颈,首次在原子分辨率上“看到”调控哺乳动物学习和记忆的“分子开关”的精细结构,揭示了内源nmda受体的组装和组成,不仅加深了神经科学领域对nmda受体介导的突触可塑性、学习和记忆等生理功能的理解,更为后续研究基于nmda受体功能障碍相关脑疾病的机制和治疗,揭示靶向nmda受体临床药物的在体作用机制奠定了重要的理论依据。
从蛋白质动态层面解读人类早期胚胎发育的成功与失败
由于蛋白质不具有核酸的可扩增特性,先前的胚胎蛋白质组学研究通常需要大量胚胎样本,或者蛋白质的鉴定深度较为有限。目前,只有少数研究从蛋白质组层面解读了早期胚胎的发育。
研究团队首先改进了前期开发的cs-upt超敏蛋白质组技术体系,通过优化裂解液体系、简化实验流程、扩展谱图数据库等,成功地在单枚人类卵细胞中鉴定出超过4500种蛋白质。随后,研究团队应用该技术绘制了人类和小鼠卵细胞及着床前胚胎发育过程中的深度蛋白质组景观图谱。在人类研究中,每个实验重复仅使用5枚卵细胞或胚胎,在不同发育阶段共鉴定近8000种蛋白质;而在小鼠研究中,每个实验重复仅使用20枚卵细胞或胚胎,共鉴定超过6300种蛋白质(见图a)。
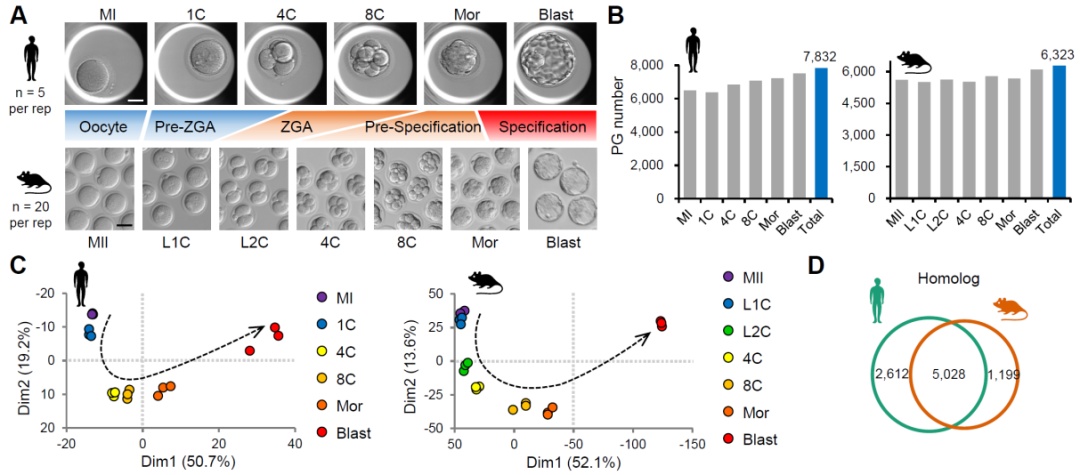
图a. 首幅着床前胚胎发育的跨物种深度蛋白质组景观图谱。
通过跨物种比较,研究团队发现人类和小鼠的蛋白质动态差异主要集中在合子基因组激活前后(pre-zga和zga)。这一发现为理解物种间合子基因组差异性调控提供了蛋白质组层面的基础。与清华大学颉伟团队及合作者绘制的翻译组图谱联合分析后,研究表明,相较于翻译激活动态,蛋白质的动态变化可分为三种类型:同步、延迟和稳定。研究人员在小鼠母源-合子转换(mzt)早期进行了翻译抑制和蛋白降解抑制实验,进一步验证了观察到的胚胎蛋白质组动态。
zga是早期胚胎发育一个关键事件,在此时期胚胎基因组首次出现大规模的转录,然而这些新的转录本的具体功能却并不清晰。在进一步整合早期胚胎转录组和翻译组信息后,研究人员对zga转录本进行了分类,并定义了两种主要类型:增加型zga(increasing zga, i-zga)和瞬时型zga(transient zga, t-zga)。
研究人员发现许多t-zga 转录本产生的蛋白质会在转录和翻译激活后持续积累,并在第一次谱系分化时期达到最高丰度。这类蛋白质被命名为“zga-burst protein”,其积累模式暗示它们可能在第一次谱系分化的调控中起到重要作用。转录组分析显示,这些zga基因的缺失未影响zga阶段的基因表达,但却显著阻碍了发育后期囊胚的形成,提供了关于 zga 如何调控第一次谱系分化的新证据。
随后,研究人员进一步选择了人类着床前低质量(poor quality, pq)胚胎形成这一常见临床事件来验证发育蛋白质图谱的应用价值。分析结果表明,不同捐赠者来源的优质(good quality, gq)胚胎在蛋白质组层面表现出高度相似性;而即便是来自同一捐赠者的pq胚胎,也可能被分为不同的亚型。除了母源蛋白质降解和新合成蛋白质增加方面的失调,这些pq胚胎普遍表现出稳定蛋白质的失调。此外,研究还揭示了一些可能导致pq胚胎形成的候选蛋白质。
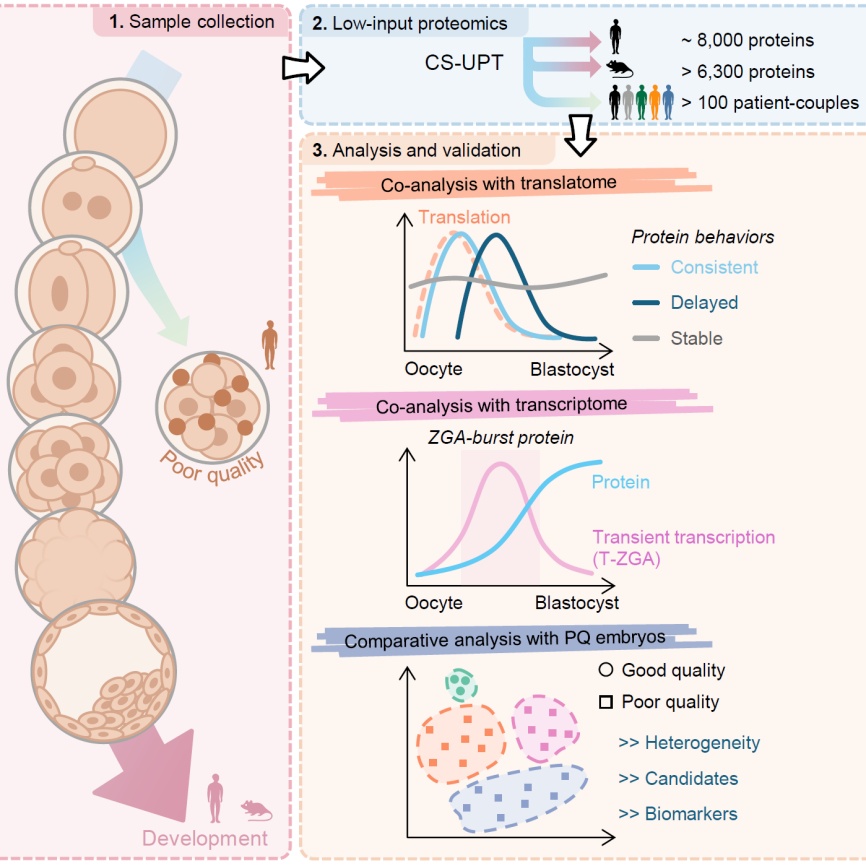
图b 研究的主要内容。
总之,该研究在技术改进、资源挖掘、发现探索和临床应用等方面进行了整合,为理解人类和小鼠的着床前胚胎发育,以及人类着床前发育失败提供了新的视角、资源和思路。
来源:中国科学院脑科学与智能技术卓越创新中心
编辑:蓝悦
↓分享
↓点赞
↓在看
上观号作者:上海科技
