
3月24日,《nature structural & molecular biology》期刊在线发表了中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)竺淑佳研究组题为《distinct structure and gating mechanism in diverse nmda receptors with glun2c and glun2d subunits》的研究论文。
该研究结合单颗粒冷冻电镜、质脂体单通道记录、电压钳记录、分子动力学模拟、质谱分析、生化验证等多维度技术,揭示了含glun2d亚基nmda受体的门控机制和功能特征,诠释了含glun2c亚基nmda受体的不对称几何构象及特异性变构调节的机制。该研究为深度理解nmda受体不同亚型的功能多样性及开发亚型选择性的小分子药物提供了理论基础(图1)。
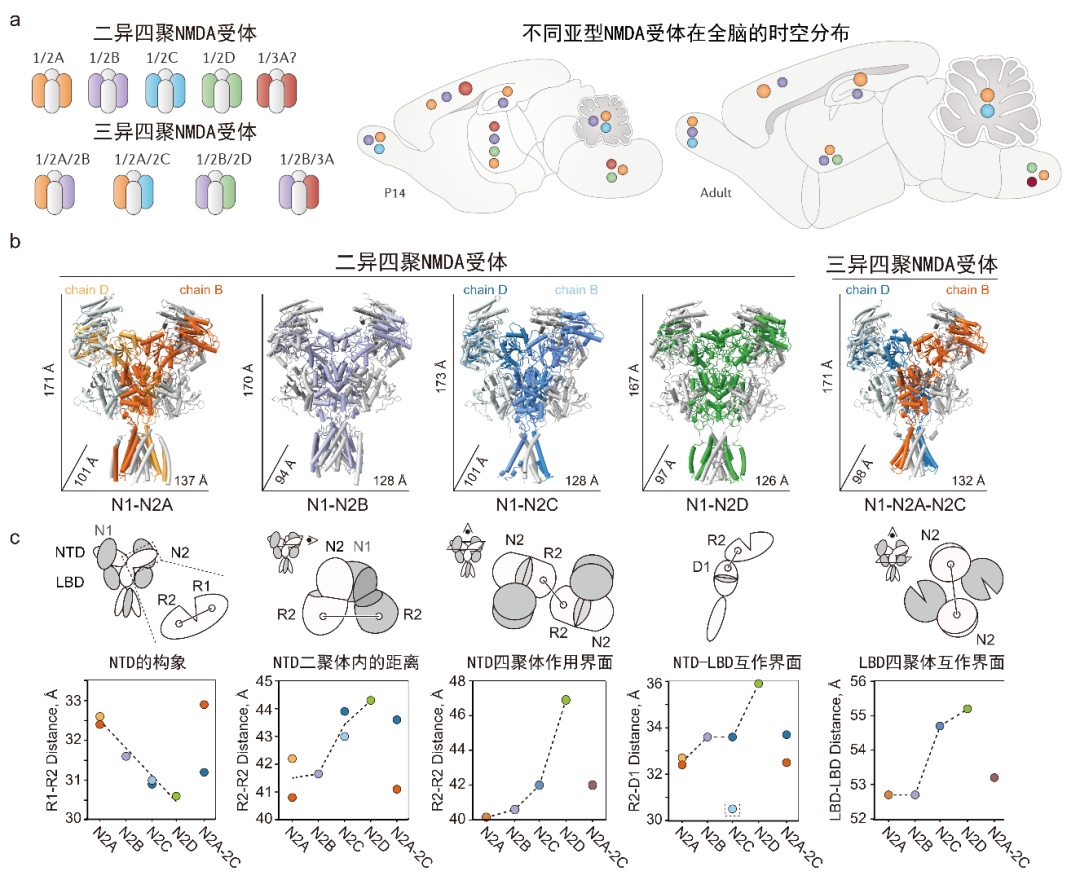
图1.决定不同nmda受体功能多样性的分子基础。a,不同nmda亚型在不同发育阶段的全脑分布(引自paoletti et al., 2013)。b,c,不同nmda受体亚型的三维结构及决定功能多样性的结构基础。
nmda受体是介导大脑突触信号传递和突触可塑性的离子通道,参与并调控神经系统的发育、学习和记忆。其功能异常与诸多神经或精神疾病的发生发展密切相关,是药物研发的重要靶点。哺乳动物大脑中的不同亚型nmda受体,其表达分布和生物物理学性质具有多样性。含有glun2a或glun2b亚基的受体具有较高的通道开放概率和较低的激动剂亲和力。相反,含有glun2c 或glun2d亚基的受体具有较低的通道开放概率和较高的激动剂亲和力。但是,决定这些功能多样性的分子基础知之甚少。
glun2d富集表达于下丘脑,杏仁核等与情绪调节密切相关的脑区。竺淑佳研究团队发现,glun1-n2d受体具有一个比其他亚型更闭合的氨基端结构域,从而使它具有较低的通道开放概率。竞争性拮抗剂r-cpp能够通过撑开谷氨酸结合口袋,进而抑制离子通道的开放。glun1上的可变剪接5号外显子可以使激动剂结合结构域扭转,从而提高离子通道的开放活性。鉴于glun1-n2d受体的离子通道开放概率与glun1-n2a受体相差50倍,研究团队基于结构在相互作用交界面引入一对二硫键,发现交联显著性地提高了glun1-n2d受体的通道活性(图2a-2d)。以上发现揭示了glun1-n2d亚型的门控机制以及决定其生物物理特征的分子基础。
研究团队进一步发现,glun1-n2c受体采取了与经典nmda受体所不同的特殊非对称构象,该特性也决定了小分子药物pyd-106只能结合相同基因编码的两个glun2c中的一个亚基(图2e,2f)。此外,研究团队还解析了在小脑颗粒细胞中高表达的glun1-n2a-n2c受体的结构。进一步分析发现,glun1-n2a-n2c受体中的glun2a和glun2c亚基分别整合了对应二异四聚体中的一个单体构象(图2g)。该研究首次揭示了glun1-n2c受体的特殊非对称几何学特性,深度阐明了小分子pyd-106选择性作用于glun1-n2c受体的机制。
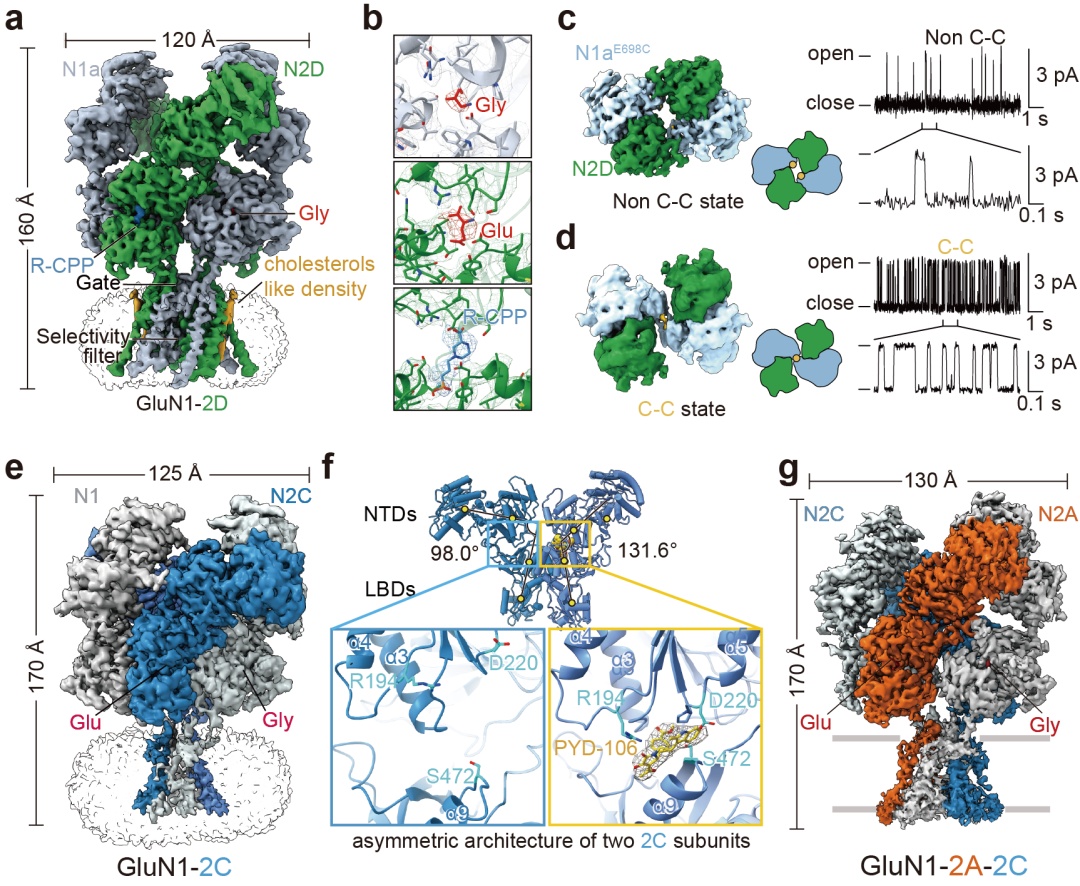
图2. 含有glun2d和glun2c受体的三维结构、门控机制和药理学特性。a,glun1-n2d受体的三维结构。b, 甘氨酸、谷氨酸和竞争性抑制剂r-cpp在其结合口袋中的电子密度云。c, d, glun1e698c-n2d突变型受体在二硫键交联和非交联状态下的三维构象和单通道性质。e, glun1-n2c受体的三维结构。f, glun1-n2c受体的非对称性构象及选择性变构抑制剂pyd-106的结合口袋。g, glun1-n2a-n2c受体的组装模式和拓扑结构。
该研究由中国科学院脑科学与智能技术卓越创新中心博士生张继林、上海药物研究所博士生张明分别完成glun2d和glun2c受体的表达与纯化、结构解析和功能研究。北京深势科技有限公司的王沁蕊、温翰和王宇航博士完成了分子动力学模拟和能量计算。大连化物所的王方军研究员和刘益哲博士完成了质谱分析。脑智卓越中心姚奋永、宋楠和寇增伟提供了电生理记录和生化实验的协助。药物所的李杨研究员和郭飞副研究员提供了glun2c结构解析的帮助。竺淑佳研究员是本文唯一通讯作者。该工作得到了科技部、国家自然科学基金委员会、中国科学院、上海市科委的资助。
来源:中国科学院脑科学与智能技术卓越创新中心
上观号作者:上海科技
