g蛋白偶联受体(g protein-coupled receptor, gpcr)在细胞信号转导中发挥重要作用,介导并调控人体的各类生命活动。这类受体与众多疾病密切相关,是最大的药物靶标蛋白家族,超过40%的上市药物通过与这些受体作用发挥其疗效,但目前还有大量靶向该家族的药物处于研发阶段,围绕gpcr的药物研发一直是国际医药产业的竞争高地。
虽然近年来对gpcr的结构与药理学研究不断有突破性成果产生,但至今仍有100余种gpcr的配体和信号转导通路不明,这些孤儿受体相关的研究极为匮乏,极大地制约了对于gpcr生理功能与信号转导机制的全面认识。值得一提的是,孤儿受体作为药物开发的“处女地”,是潜在的药物靶标“源泉”,为创新药物研发带来机遇。
近日,中国科学院上海药物研究所吴蓓丽研究组、赵强研究组联合上海科技大学水雯箐研究组,在孤儿受体信号转导机制研究方面取得突破性进展。该研究团队成功解析两种黏附类gpcr(adhesion gpcr)adgrd1和adgrf1分别与g蛋白结合的复合物三维结构,并开展了深入的功能相关性研究,首次阐明这类孤儿受体自发激活的分子机制,为研究该类受体的信号转导机理和未来的药物设计提供了重要依据。相关研究论文于北京时间2022年4月13日在国际顶级学术期刊nature上在线发表。

黏附类gpcr包含33种受体,参与调控免疫反应、器官发育和细胞通讯等生理过程,与精神分裂症、多动症和癌症等多种疾病密切相关。然而,该类受体是目前研究最不透彻的gpcr家族,几乎所有成员都是配体未知和功能不明的孤儿受体,其结构和功能研究的匮乏严重制约了相关的药物研发进程。adgrd1和adgrf1作为两种黏附类受体,被发现是多种癌症的致癌基因,但其在分子水平上如何被激活和调控,相关的作用机制仍不清楚。
此次,上海药物所的联合研究团队通过测定adgrd1和adgrf1分别与g蛋白结合的复合物结构,发现受体自身的一部分可作为内源性激动剂,使受体激活。这个充当激动剂的部分是位于受体胞外结构域和跨膜结构域之间的一段多肽(包含约20个氨基酸),被称为“stalk”。该区段通过与受体跨膜结构域作用,导致跨膜螺旋发生构象变化,从而激活受体,使其与g蛋白结合。这种受体自发激活方式从未在其它类型gpcr中被发现,充分体现了黏附类受体信号转导机制的独特性。
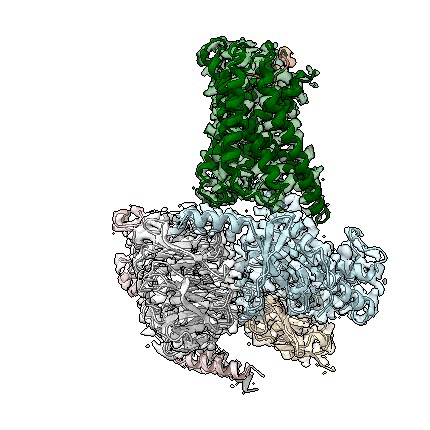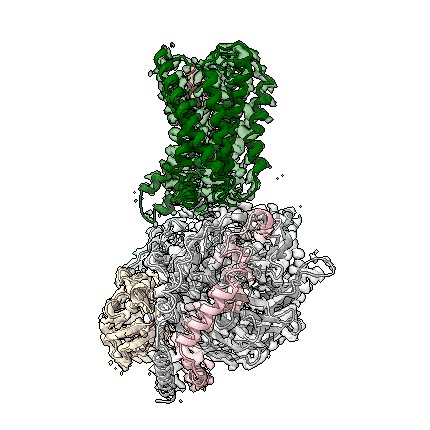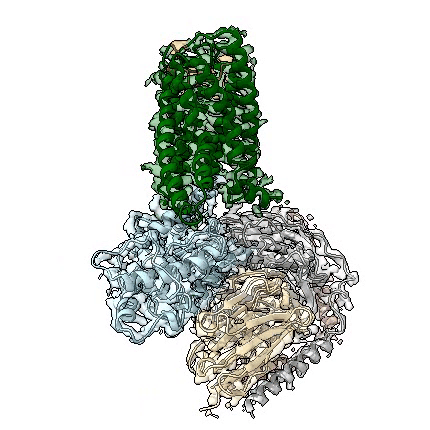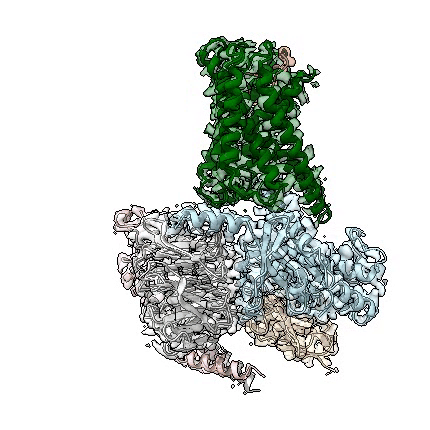
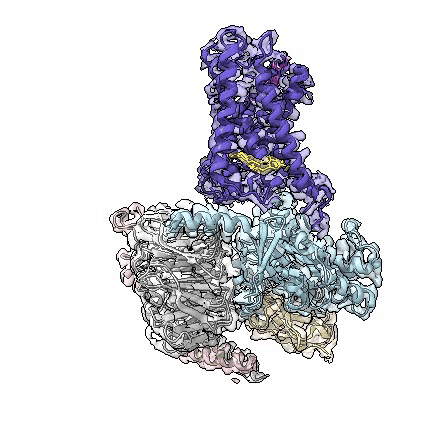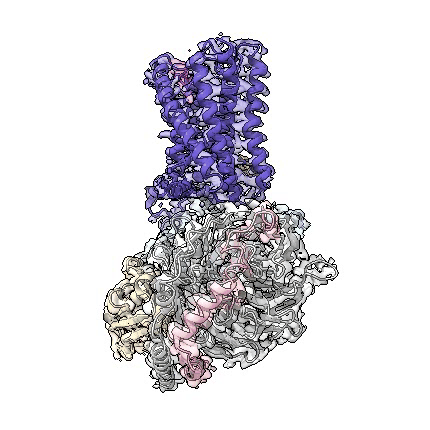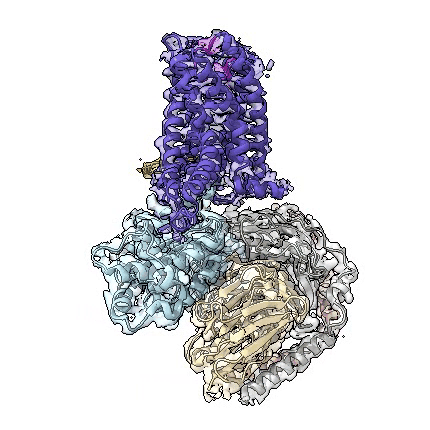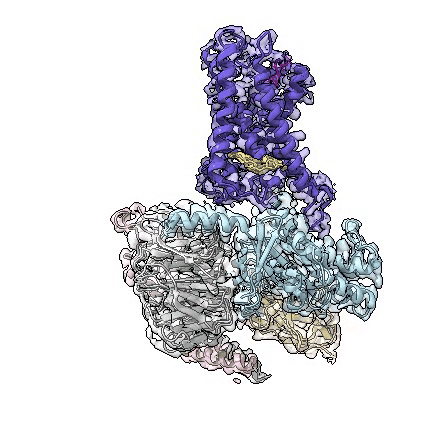
adgrd1和adgrf1分别与g蛋白结合的复合物三维结构动图
不同于其它gpcr,黏附类受体的n端含有一个巨大的胞外结构域,不同类型黏附类受体的胞外结构域组成差异巨大。尽管如此,几乎所有黏附类受体的胞外结构域中都包含一个自剪切结构域(gpcr autoproteolysis-inducing, gain),该结构域中含有一个自剪切位点,使受体断裂成n端和c端两个部分,自剪切位点和跨膜结构域之间的区段即为stalk。以往研究发现,虽然受体发生断裂,stalk仍然与gain结构域的其它部分紧密结合。而adgrd1和adgrf1与g蛋白的复合物结构显示,stalk从gain结构域中脱离,发生显著的构象变化,促使其伸入到受体跨膜结构域的结合口袋中,这说明stalk的构象重排对于受体激活至关重要。
以往人们普遍认为黏附类受体发生自剪切有利于gain结构域释放stalk,从而促进受体自激活。然而,此次研究人员将adgrd1和adgrf1的自剪切位点突变,使其丧失自剪切能力,受体激活下游信号通路的能力却没有发生显著变化。更加出乎意料的是,研究人员进一步解析了adgrf1自剪切突变体与g蛋白的复合物结构,发现stalk仍能通过同样的方式与跨膜结构域作用激活受体。这些研究结果表明,自剪切对于stalk释放和受体自激活不是必需的。
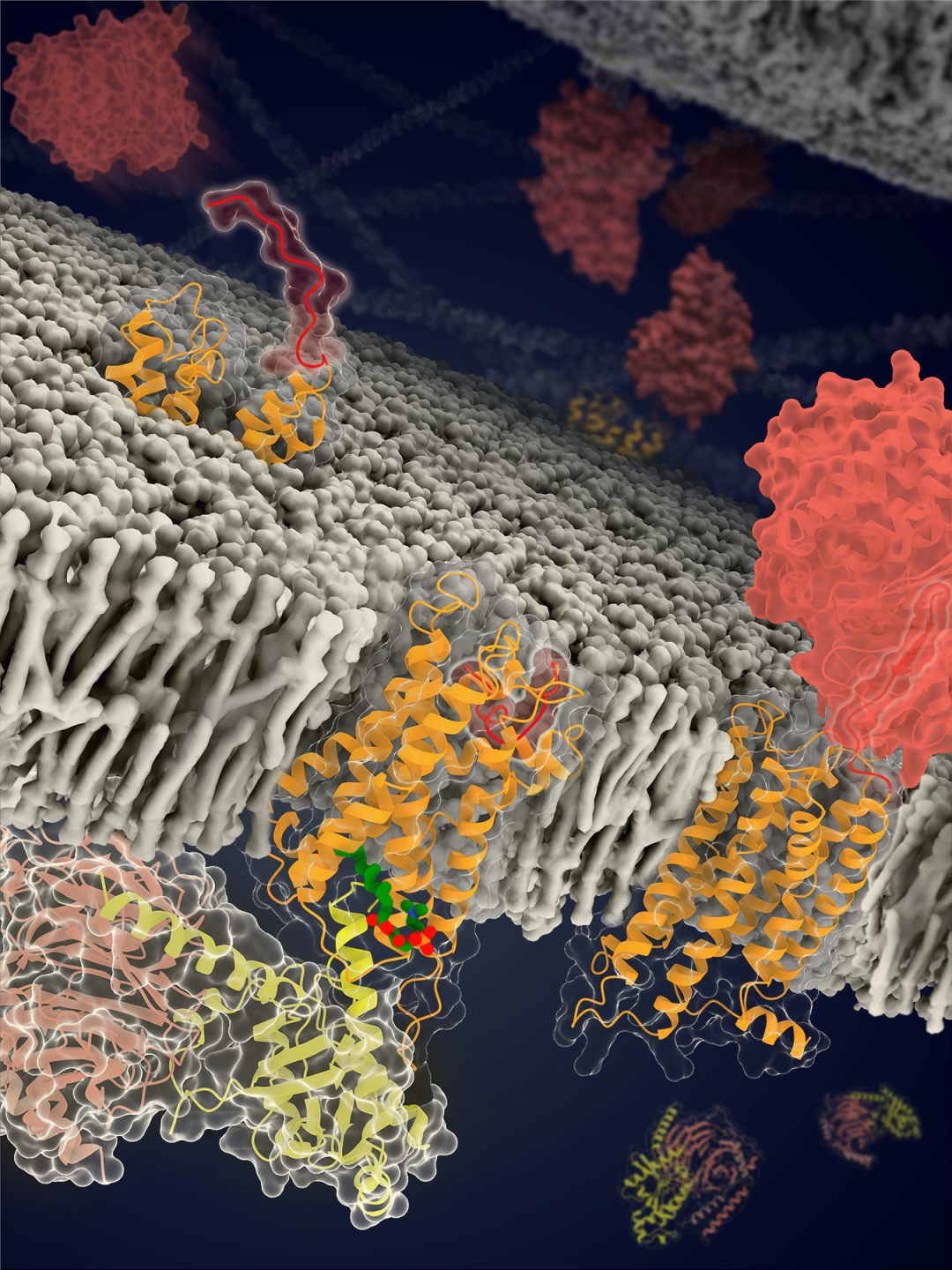
黏附类受体结构示意图。黏附类受体在细胞黏附和信号转导中发挥重要作用,是癌症和神经系统疾病等的潜在药物作用靶点。图中处于不同功能状态的adgrf1结构或模型用橙色飘带图表示,受体中的stalk区域用红色表示,脂分子lpc用绿色表示,gain结构域为砖红色,g蛋白的三个亚基分别为黄色,浅粉色和浅灰色。(图片由吴蓓丽研究组提供)
adgrd1和adgrf1的氨基酸序列相似性很低,但这两种受体的结构显示stalk与跨膜结构域之间形成的相互作用力非常相似,提示不同类型黏附类受体可能通过类似的方式自发激活下游信号通路。进一步分析发现,不同跨膜螺旋中的氨基酸凭借彼此间的相互作用形成一系列作用力核心,这些作用力核心像传递“接力棒”一样,将stalk在受体细胞外侧区域引发的构象变化向细胞内侧方向传送,最终完全激活受体。对受体的功能研究显示,将构成这些作用力核心的氨基酸突变后,受体自激活的能力显著下降,表明这些作用力对于受体激活至关重要。
这些结构和功能信息为药物设计提供了精准的模板,将有助于靶向这两种黏附类受体的癌症治疗药物开发。
该研究的另外一项重要发现是一种天然脂分子通过与adgrf1特异性结合对受体功能进行调控。联合研究团队在adgrf1与g蛋白的复合物结构中发现一个脂分子与受体中g蛋白结合口袋附近的一个位点结合,而在另一个受体adgrd1的结构中则没有发现脂分子。研究人员进一步利用质谱与组学技术鉴定该脂分子的结构为溶血磷脂胆碱(lysophosphatidylcholine,lpc)。进一步的功能研究表明,lpc可能通过稳定受体胞内侧区域的构象促进受体激活。这是首次发现细胞膜的脂质成分lpc与gpcr结合并对受体功能发挥调控作用,极大地拓展了对于gpcr功能调控机制的认识。

★


图为本研究部分第一作者。左起邱娜、瞿向利、王沐。
中国科学院上海药物研究所吴蓓丽研究员、赵强研究员和上海科技大学水雯箐教授是研究论文的共同通讯作者,第一作者是上海药物所博士生瞿向利、硕士生邱娜和上海科技大学博士生王沐、助理研究员张冰洁。研究工作获得国家自然科学基金委员会、国家科技部、中国科学院和上海市科学技术委员会等部门的经费支持。
来源:中科院上海药物所
上观号作者:上海科技
